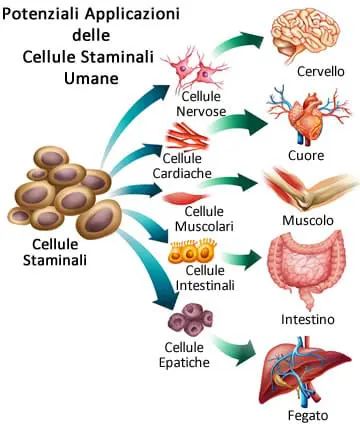
Este enfoque tuvo en cuenta el hecho de que la progresión de la AMD comienza con la degeneración del epitelio pigmentario de la retina y la membrana de Bruch subyacente y solo posteriormente continúa con la pérdida de fotorreceptores y el daño a la coroides. El epitelio pigmentario de la retina es un tejido fundamental para la función visual, ya que nutre y apoya a los fotorreceptores, por lo que la sustitución del epitelio pigmentario de la retina dañado por tejido nuevo y sano podría restaurar la visión.
El posicionamiento correcto del parche en el espacio subretiniano se controló mediante biomicroscopía estéreo, fotografía de fondo de ojo y tomografía de coherencia óptica de dominio espectral (SD-OCT).
Posteriormente, los investigadores siguieron a los pacientes para verificar la seguridad de la implantación de los parches, el porcentaje de ocurrencia y la gravedad de los eventos adversos y la mejora de la agudeza visual en los ojos tratados.
El estudio demostró que la implantación del parche es un procedimiento seguro, de hecho solo ocurrieron tres eventos adversos, de los cuales solo uno estuvo directamente relacionado con el procedimiento de implantación del parche y consistió en un desprendimiento de retina inmediato manejado quirúrgicamente con éxito. Los otros dos eventos adversos estaban relacionados con el uso de inmunosupresores: la prednisona administrada por vía oral antes de la cirugía perjudicó el control glucémico en un paciente diabético, mientras que la implantación de un dispositivo de cortisona de liberación lenta dentro de la cavidad vítrea causó un problema en otro paciente. Estos eventos adversos también se manejaron de manera efectiva con las terapias apropiadas.
Además de la seguridad del procedimiento, el estudio demostró la supervivencia del parche y de las células del epitelio pigmentario de la retina in vivo a los 12 meses posteriores a la implantación, con evidencia de que las células trasplantadas se habían integrado con el epitelio pigmentario de la retina nativo, mostrando también signos de la actividad celular (fagocitosis). No hubo evidencia de transformación neoplásica.
En dos pacientes también se pudo destacar una mejoría en la agudeza visual medida en la tabla EDTRS (Estudio de Retinopatía Diabética en Tratamiento Temprano): de 10 a 39 letras en un caso y de 8 a 29 letras en el segundo caso. En ambos casos la fijación visual estaba centrada en el parche y la visión incluía también la zona del propio parche. El análisis electrorretinográfico (ERG) mostró una ligera disminución de la función de los fotorreceptores a los 6 meses del implante, con la consiguiente alteración de la electroculografía (EOG). La función de los fotorreceptores permaneció alterada en un paciente, pero se recuperó en el otro paciente durante los 12 meses de seguimiento. En ningún caso fue necesario realizar una terapia inyectable con anti-VEGF.
El ojo está especialmente indicado para la aplicación de terapias basadas en el uso de células madre, ya que representa un compartimento separado del resto del cuerpo gracias a la presencia de la barrera hematooftálmica, por lo que las células madre trasplantadas no sólo permanecen confinados en el interior del ojo, pero también pueden ser monitorizados y, en el caso de fenómenos neoplásicos, destruidos. Además, las reacciones de rechazo se pueden prevenir inmunosuprimiendo localmente, solo dentro del ojo, sin tener que intervenir sistémicamente.
Este estudio demostró la viabilidad de un parche que consiste en una capa de células del epitelio pigmentario de la retina derivadas de células embrionarias humanas, la seguridad de la implantación del parche en el espacio subretiniano en términos de ausencia de toxicidad y la supervivencia del parche y de las células de la retina. epitelio pigmentario de la retina 12 meses después del implante únicamente por inmunosupresión local.
La mejora visual obtenida con esta nueva técnica podría radicar en que las células del epitelio pigmentario de la retina implantadas son células nuevas y jóvenes, a diferencia de las del paciente, que suele tener más de 60 años. Además, las células derivadas de células madre no tienen una predisposición genética a desarrollar DMAE ni una predisposición determinada por la exposición a factores de riesgo (tabaquismo, radiación UV, etc.). Debido a la ausencia de pacientes utilizados como controles (simulado), los autores no pueden descartar que la mejoría visual pueda deberse al trasplante solo o a una extracción no intencional de la membrana neovascular subcoroidea, sin embargo, la concomitancia de la presencia del parche, la la supervivencia del RPE derivado de células madre, la presencia y función de los fotorreceptores, la sensibilidad retiniana y la perfusión coroidea sugieren que la mejora se debe a la implantación del parche.
Los 12 meses de seguimiento del estudio son suficientes para determinar la seguridad del procedimiento y la supervivencia de las células en el tiempo pero no para definir el peligro de teratogenicidad tardía, por lo que los pacientes serán monitorizados durante 5 años más. .
Creemos poder decir que, con todas las limitaciones de una técnica en etapa temprana, este nuevo enfoque terapéutico representa un punto de partida muy alentador y un hito en la oftalmología en cuanto a la terapia celular basada en células madre, por lo que seguiremos con gran interés los desarrollos futuros. de esta línea de investigación con la esperanza de que pronto ofrezca una cura concreta a los millones de afectados por la DMAE y otras enfermedades degenerativas de la retina.
La mejora visual obtenida con esta nueva técnica podría radicar en que las células del epitelio pigmentario de la retina implantadas son células nuevas y jóvenes, a diferencia de las del paciente, que suele tener más de 60 años. Además, las células derivadas de células madre no tienen una predisposición genética a desarrollar DMAE ni una predisposición determinada por la exposición a factores de riesgo (tabaquismo, radiación UV, etc.). Debido a la ausencia de pacientes utilizados como controles (simulado), los autores no pueden descartar que la mejoría visual pueda deberse al trasplante solo o a una extracción no intencional de la membrana neovascular subcoroidea, sin embargo, la concomitancia de la presencia del parche, la la supervivencia del RPE derivado de células madre, la presencia y función de los fotorreceptores, la sensibilidad retiniana y la perfusión coroidea sugieren que la mejora se debe a la implantación del parche.
Los 12 meses de seguimiento del estudio son suficientes para determinar la seguridad del procedimiento y la supervivencia de las células en el tiempo pero no para definir el peligro de teratogenicidad tardía, por lo que los pacientes serán monitorizados durante 5 años más. .
Creemos poder decir que, con todas las limitaciones de una técnica en etapa temprana, este nuevo enfoque terapéutico representa un punto de partida muy alentador y un hito en la oftalmología en cuanto a la terapia celular basada en células madre, por lo que seguiremos con gran interés los desarrollos futuros. de esta línea de investigación con la esperanza de que pronto ofrezca una cura concreta a los millones de afectados por la DMAE y otras enfermedades degenerativas de la retina.

